AffaMed Therapeutics(以下简称 “AffaMed”)的合作伙伴,Ocular Therapeutix, Inc.(纳斯达克股票代码:OCUL),一家专注于眼部疾病和创新疗法制定、开发和商业化的生物制药公司,近日宣布美国食品和药物管理局(以下简称“FDA”)已批准其针对 DEXTENZA® 的补充新药申请(以下简称“sNDA”),以对应增加治疗过敏性结膜炎相关眼痒的适应症。
据统计,美国每年估计有 1000 万人会因常年和季节性过敏原引发的过敏性结膜炎伴随的相关炎症就医。在中国,过敏性结膜炎的发病率高达 10%,相当于每十位中国人中就有一位可能患有过敏性结膜炎。美国和中国的过敏性结膜炎患病情况表明,在除已获批的眼部术后抗炎缓解疼痛的适应症之外,DEXTENZA 还可通过治疗新的适应症,造福更多患者。
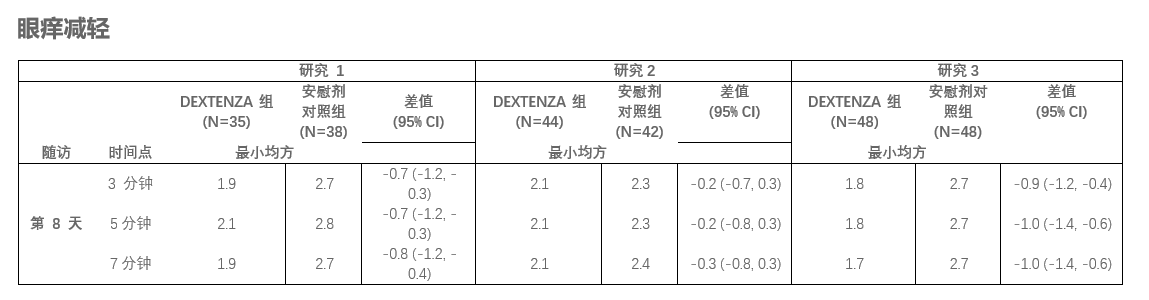
DEXTENZA 治疗与过敏性结膜炎相关眼痒的临床有效性基于三个随机的多中心、双盲、平行对照组研究得出。研究对象存在眼部过敏史,且常年和季节性过敏原结膜反应及皮肤针刺为阳性(n=255)。所有三项研究试验中,DEXTENZA 组在长达 30 天研究期间内的所有时间点都显示出与安慰剂对照组相比更低的眼痒平均评分。与安慰剂对照组相比,在三项研究试验中,DEXTENZA组在其中两项研究试验的第8天,结膜激发试验的后 3 、5 和 7 分钟时,出现有统计学意义的更高比例的患者眼痒减轻。所有三项研究的主要终点第 8 天眼痒数据如下 (0-4 分量表):
在此次顺利获得批准后,DEXTENZA 已成为首款经 FDA 认可,不含防腐剂、无创治疗过敏性结膜炎相关眼痒的泪小管植入剂。药物的植入操作需要由有资质的医生完成,单次植入后,药物可在长达一个月的时间内持续释放。DEXTENZA 最初于 2018 年 11 月获得美国 FDA 批准用于治疗眼科手术后的眼部疼痛,并于 2019 年 6 月扩展适应症,获批用于治疗眼科手术后的眼部炎症。
AffaMed 于 2020 年 10 月与 Ocular 达成许可协议,获得在大中华区(包括中国大陆、香港、澳门和台湾)、韩国和东盟国家(文莱、柬埔寨、印度尼西亚、老挝、马来西亚、缅甸、菲律宾、新加坡、泰国和越南)开发 DEXTENZA 治疗眼科手术后炎症和疼痛,以及过敏性结膜炎患者眼部瘙痒的独家权利。目前,AffaMed 正与中国国家药品监督管理局 (NMPA) 密切合作,探索在中国加快 DEXTENZA 注册进程的途径。
1. Leonardi A, Castegnaro A, Valerio ALG, Lazzarini D. Epidemiology of allergic conjunctivitis: clinical appearance and treatment patterns in a population-based study. Curr Opin Allergy Clin Immunol. 2015;15(5):482-488.
2. Rosario N, Bielory L. Epidemiology of allergic conjunctivitis. Curr Opin Allergy Clin Immunol. 2011;11(5):471-476
3. Ora website, An Update on Ocular Allergy Trends, 2019 Ora, Inc., www.oraclinical.com
关于 DEXTENZA
DEXTENZA 获美国食品药品监督管理局 (FDA) 批准用于治疗眼科手术后的眼部炎症和疼痛,以及与过敏性结膜炎有关的眼痒。作为一款皮质类固醇的泪小管植入物,DEXTENZA 不含防腐剂,可无创植入到下眼睑内侧的泪小管内,持续 30 天向眼表缓释地塞米松。无需另行取出,DEXTENZA 会在鼻泪管系统自行吸收并排出。

